05-03-2010 08:47 Chemical Princess » Электролит
Или что нового я узнала (:
Определение массовой доли железа
Метод основан на образовании ионами железа I и III в аммиачной среде с сульфосалициловой кислотой комплексов, окрашенных в желтый цвет и имеющих одинаковый коэффициент поглощения.
Реактивы и растворы:кислота сульфосалициловая по ГОСТ 4478, раствор с массовой долей 30%;
кислота серная по ГОСТ 4204; (1/2 H2SО4) = 0,1* моль/дм3 (0,1 н. раствор);
квасцы железоаммонийные;
аммиак водный по ГОСТ 3760, раствор с массовой долей 10%;
раствор железа, содержащий 1 мг Fe3+ в 1 см3; готовят по ГОСТ 4212 (раствор А).
25 см3 раствора А помещают в мерную колбу вместимостью 1 дм3, доводят объем раствора до метки раствором серной кислоты и перемешивают (раствор Б); 1 см3 раствора Б содержит 0,025 мг Fe3+ (раствор готовят в день его применения).
Построение градуировочного графика
Для построения градуировочного графика готовят образцовые растворы. В мерные колбы вместимостью 100 см3 вносят бюреткой 1; 2; 4; 6; 8 и 10 см3 раствора Б, что соответствует содержанию в них 0,025; 0,050; 0,100; 0,150; 0,200 и 0,250 мг железа.
Затем приливают в каждую колбу по 2 см3 раствора сульфосалициловой кислоты и 15 см3 аммиака. Объем раствора в каждой колбе доводят до метки водой и перемешивают. Оптическую плотность полученных образцовых растворов измеряют в фотоколориметре при длине волны 440 нм (синий светофильтр) в кюветах с толщиной поглощающего свет слоя 20 мм, используя в качестве раствора сравнения раствор, содержащий все реактивы, кроме раствора Б. По данным значений оптических плотностей строят градуировочный график, откладывая по оси абсцисс содержащиеся в образцовых растворах количества железа в миллиграммах, а по оси ординат - соответствующие им значения оптических плотностей.
При переходе к работе с новыми реактивами градуировочный график необходимо проверить.
Проведение анализа
В мерную колбу вместимостью 100 см3 наливают 50 см3 воды и вносят 10 см3 анализируемой кислоты. По охлаждении объем раствора доводят до метки водой и перемешивают. 10 см3 полученного раствора переносят в мерную колбу вместимостью 100 см3, приливают 2 см3 раствора сульфосалициловой кислоты и 15-20 см3 раствора аммиака (аммиак должен быть в избытке, поэтому количество его можно увеличить до явного запаха).
Раствор перемешивают, охлаждают до комнатной температуры, доводят водой до метки и перемешивают. Затем проводят измерения на фотоэлектроколориметре, как указано при построении градуировочного графика.
Обработка результатов
Массовую долю железа (X1) в процентах вычисляют по формуле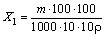
,
где m - масса железа, найденная по градуировочному графику, мг;
r - плотность анализируемой кислоты, г/см3.
За результат анализа принимают среднее арифметическое двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,001% при доверительной вероятности P = 0,95.
Определение наличия хлористых соединений
Метод основан на визуальном определении соединений хлора в виде хлористого серебра, при сравнении интенсивности помутнения раствора анализируемой кислоты со шкалой стандартов.
Реактивы и растворы:кислота азотная по ГОСТ 4461, разбавленная 1:10;
натрий хлористый по ГОСТ 4233;
серебро азотнокислое по ГОСТ 1277, раствора c (AgNO3) = 0,1 моль/дм3 (0,1 н. раствор);
раствор, содержащий 1 мг Сl в 1 см3, готовят по ГОСТ 4212 (раствор А);
10 см3 раствора А помещают в мерную колбу вместимостью 1 дм3, доводят объем раствора водой до метки, тщательно перемешивают (раствор Б). 1 см3 раствора Б содержит 0,01 мг Сl (раствор готовят в день его применения).
Приготовление растворов сравнения
В цилиндры с притертыми пробками вместимостью 100 см3 наливают по 50 см3 воды и при помощи бюретки 2; 4; 6; 8 и 10 см3 раствора Б, что соответствует содержанию в них 0,02; 0,04; 0,06; 0,08 и 0,10 мг хлора.
К растворам прибавляют по 2 см3 азотной кислоты и по 2 см3 раствора азотнокислого серебра. Объемы растворов доводят водой до 100 см3 и перемешивают. Растворы сравнения готовят одновременно с анализируемым раствором.
Проведение анализа
Проводят качественную пробу на содержание в кислоте хлориона. Для этого в цилиндр вместимостью 100 см3 вливают 50 см3 воды, 2 см3 раствора азотной кислоты, 2 см3 раствора азотнокислого серебра и 10 см3 анализируемой кислоты. Полученный раствор на 15 мин оставляют в покое и наблюдают, остается ли раствор прозрачным или образовалось помутнение от наличия в кислоте ионов хлора. В последнем случае готовят растворы сравнения, как изложено в п. 3.8.2. В цилиндр с притертой пробкой вместимостью 100 см3 вливают 50 см3 воды и пипеткой вносят 10 см3 анализируемой кислоты. Раствор охлаждают и приливают к нему 2 см3 раствора азотной кислоты и 2 см3 раствора азотнокислого серебра. Объем раствора доводят водой до 100 см3, оставляют в течение 15 мин в покое и сравнивают интенсивности помутнения анализируемого раствора и растворов сравнения.
Определение массовой доли железа
Метод основан на образовании ионами железа I и III в аммиачной среде с сульфосалициловой кислотой комплексов, окрашенных в желтый цвет и имеющих одинаковый коэффициент поглощения.
Реактивы и растворы:кислота сульфосалициловая по ГОСТ 4478, раствор с массовой долей 30%;
кислота серная по ГОСТ 4204; (1/2 H2SО4) = 0,1* моль/дм3 (0,1 н. раствор);
квасцы железоаммонийные;
аммиак водный по ГОСТ 3760, раствор с массовой долей 10%;
раствор железа, содержащий 1 мг Fe3+ в 1 см3; готовят по ГОСТ 4212 (раствор А).
25 см3 раствора А помещают в мерную колбу вместимостью 1 дм3, доводят объем раствора до метки раствором серной кислоты и перемешивают (раствор Б); 1 см3 раствора Б содержит 0,025 мг Fe3+ (раствор готовят в день его применения).
Построение градуировочного графика
Для построения градуировочного графика готовят образцовые растворы. В мерные колбы вместимостью 100 см3 вносят бюреткой 1; 2; 4; 6; 8 и 10 см3 раствора Б, что соответствует содержанию в них 0,025; 0,050; 0,100; 0,150; 0,200 и 0,250 мг железа.
Затем приливают в каждую колбу по 2 см3 раствора сульфосалициловой кислоты и 15 см3 аммиака. Объем раствора в каждой колбе доводят до метки водой и перемешивают. Оптическую плотность полученных образцовых растворов измеряют в фотоколориметре при длине волны 440 нм (синий светофильтр) в кюветах с толщиной поглощающего свет слоя 20 мм, используя в качестве раствора сравнения раствор, содержащий все реактивы, кроме раствора Б. По данным значений оптических плотностей строят градуировочный график, откладывая по оси абсцисс содержащиеся в образцовых растворах количества железа в миллиграммах, а по оси ординат - соответствующие им значения оптических плотностей.
При переходе к работе с новыми реактивами градуировочный график необходимо проверить.
Проведение анализа
В мерную колбу вместимостью 100 см3 наливают 50 см3 воды и вносят 10 см3 анализируемой кислоты. По охлаждении объем раствора доводят до метки водой и перемешивают. 10 см3 полученного раствора переносят в мерную колбу вместимостью 100 см3, приливают 2 см3 раствора сульфосалициловой кислоты и 15-20 см3 раствора аммиака (аммиак должен быть в избытке, поэтому количество его можно увеличить до явного запаха).
Раствор перемешивают, охлаждают до комнатной температуры, доводят водой до метки и перемешивают. Затем проводят измерения на фотоэлектроколориметре, как указано при построении градуировочного графика.
Обработка результатов
Массовую долю железа (X1) в процентах вычисляют по формуле
,
где m - масса железа, найденная по градуировочному графику, мг;
r - плотность анализируемой кислоты, г/см3.
За результат анализа принимают среднее арифметическое двух параллельных определений, допускаемые расхождения между которыми не должны превышать 0,001% при доверительной вероятности P = 0,95.
Определение наличия хлористых соединений
Метод основан на визуальном определении соединений хлора в виде хлористого серебра, при сравнении интенсивности помутнения раствора анализируемой кислоты со шкалой стандартов.
Реактивы и растворы:кислота азотная по ГОСТ 4461, разбавленная 1:10;
натрий хлористый по ГОСТ 4233;
серебро азотнокислое по ГОСТ 1277, раствора c (AgNO3) = 0,1 моль/дм3 (0,1 н. раствор);
раствор, содержащий 1 мг Сl в 1 см3, готовят по ГОСТ 4212 (раствор А);
10 см3 раствора А помещают в мерную колбу вместимостью 1 дм3, доводят объем раствора водой до метки, тщательно перемешивают (раствор Б). 1 см3 раствора Б содержит 0,01 мг Сl (раствор готовят в день его применения).
Приготовление растворов сравнения
В цилиндры с притертыми пробками вместимостью 100 см3 наливают по 50 см3 воды и при помощи бюретки 2; 4; 6; 8 и 10 см3 раствора Б, что соответствует содержанию в них 0,02; 0,04; 0,06; 0,08 и 0,10 мг хлора.
К растворам прибавляют по 2 см3 азотной кислоты и по 2 см3 раствора азотнокислого серебра. Объемы растворов доводят водой до 100 см3 и перемешивают. Растворы сравнения готовят одновременно с анализируемым раствором.
Проведение анализа
Проводят качественную пробу на содержание в кислоте хлориона. Для этого в цилиндр вместимостью 100 см3 вливают 50 см3 воды, 2 см3 раствора азотной кислоты, 2 см3 раствора азотнокислого серебра и 10 см3 анализируемой кислоты. Полученный раствор на 15 мин оставляют в покое и наблюдают, остается ли раствор прозрачным или образовалось помутнение от наличия в кислоте ионов хлора. В последнем случае готовят растворы сравнения, как изложено в п. 3.8.2. В цилиндр с притертой пробкой вместимостью 100 см3 вливают 50 см3 воды и пипеткой вносят 10 см3 анализируемой кислоты. Раствор охлаждают и приливают к нему 2 см3 раствора азотной кислоты и 2 см3 раствора азотнокислого серебра. Объем раствора доводят водой до 100 см3, оставляют в течение 15 мин в покое и сравнивают интенсивности помутнения анализируемого раствора и растворов сравнения.